|
|
|
|
|
Глава 11. Взаимные превращения жидкостей и газов § 69. Давление насыщенного параКак вы думаете, что будет происходить с насыщенным паром, если уменьшить занимаемый им объём: например, если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной? При сжатии пара равновесие начнёт нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнёт переходить большее число молекул, чем из жидкости в газ. Ведь число молекул, покидающих жидкость в единицу времени, зависит только от температуры, и сжатие пара это число не меняет. Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара, а значит, и концентрация его молекул не примут прежних своих значений. Следовательно,
Так как давление пропорционально концентрации молекул (р = nkT), то из этого определения следует, что
При сжатии насыщенного пара всё большая часть его переходит в жидкое состояние. Жидкость данной массы занимает меньший объём, чем пар той же массы. В результате объём пара при неизменной его плотности уменьшается. Отметим ещё один важный факт.
Ненасыщенный пар
При уменьшении объёма (рис. 11.1) давление ненасыщенного пара увеличивается (участок 1—2) подобно тому, как изменяется давление при уменьшении объёма идеального газа. При определённом объёме пар становится насыщенным, и при дальнейшем его сжатии происходит превращение его в жидкость (участок 2—3). В этом случае над жидкостью уже будет находиться насыщенный пар. Как только весь пар превратится в жидкость, дальнейшее уменьшение объёма вызовет резкое увеличение давления (жидкость малосжимаема). Однако пар превращается в жидкость не при любой температуре. Если температура выше некоторого значения, то, как бы мы ни сжимали газ, он никогда не превратится в жидкость.
Каждому веществу соответствует своя критическая температура, у гелия Tкр = 4 К, у азота Tкр = 126 К.
Свойства насыщенного и ненасыщенного пара различны. Зависимость давления насыщенного пара от температуры. Состояние насыщенного пара, как показывает опыт, приближённо описывается уравнением состояния идеального газа (10.4), а его давление определяется формулой рн. п = nkT. (11.1) С ростом температуры давление растёт.
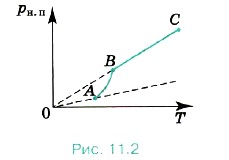
Однако зависимость давления рн. п от температуры Т, найденная экспериментально, не является прямо пропорциональной, как у идеального газа при постоянном объёме. С увеличением температуры давление реального насыщенного пара растёт быстрее, чем давление идеального газа (рис. 11.2, участок кривой АВ). Это становится очевидным, если провести изохоры идеального газа через точки А и В (штриховые прямые). Почему это происходит? При нагревании жидкости в закрытом сосуде часть жидкости превращается в пар. В результате согласно формуле (11.1)
В основном увеличение давления при повышении температуры определяется именно увеличением концентрации. Главное различие в поведении идеального газа и насыщенного пара состоит в том, что
Жидкость частично превращается в пар, или, напротив, пар частично конденсируется. С идеальным газом ничего подобного не происходит. Когда вся жидкость испарится, пар при дальнейшем нагревании перестанет быть насыщенным и его давление при постоянном объёме будет возрастать прямо пропорционально абсолютной температуре (см. рис. 11.2, участок кривой ВС).
|
|
|



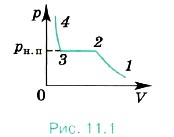
 Предположите, как ведут себя молекулы пара и жидкости на разных участках кривой (см. рис. 11.1).
Предположите, как ведут себя молекулы пара и жидкости на разных участках кривой (см. рис. 11.1).